癌细胞以冬眠方式躲过化疗
时间回到三年前,加拿大玛格丽特公主癌症中心的Catherine O'Brien博士听了一场学术报告,内容与她研究的消化道癌症似乎并没有什么直接关系,讲的是小鼠的胚胎发育,有一种被称为“滞育”(diapause)的奇妙现象。事实上,科学家们发现,包括小鼠在内的100多种哺乳动物可以在高温、寒冷或缺乏食物等不利条件下,让胚胎暂停发育,等到环境条件转好后,再让妊娠继续。
人类似乎失去了这种胚胎滞育的能力,但O'Brien博士灵光一闪:“癌细胞会不会是利用这种生存机制在恶劣的化疗环境中活下来?”为了检验这种可能性,她与作报告的科学家Miguel Ramalho-Santos博士取得联系,并展开了合作。
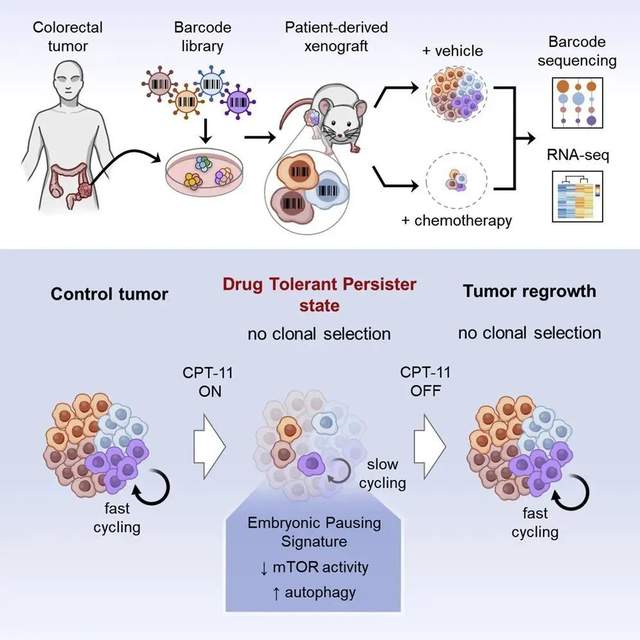
研究人员将一些来自结肠癌患者的肿瘤细胞放在培养皿中培养,并用化疗药物进行处理。原本快速增殖的癌细胞分裂速度减慢,代谢大大降低。利用先进的测序技术,检查这些癌细胞的基因表达谱发现,它们与滞育小鼠胚胎有着惊人的相似性。结合测序结果和数学模型的分析还显示,能够进入类似滞育状态的癌细胞并非只是具有特定基因表达特性的一小群细胞,而是所有癌细胞。
“肿瘤就像一个完整的生物体,能够进入缓慢分裂的状态,节省能量,提高存活能力。”O'Brien博士描述道。你可以把这些癌细胞想象成进入冬眠的熊,另一位研究作者Aaron Schimmer补充说。冬眠的熊会醒来,在停止使用化疗药物处理后,癌细胞们也会再次全速增殖。
那么,有办法不让冬眠的熊醒来吗?进一步探索背后的机制,研究人员发现,与滞育的胚胎相似,处于缓慢分裂状态的癌细胞,需要激活一种叫作“自噬”(autophagy)的细胞过程。也就是说,它们会循环使用自身的蛋白质或细胞成分,以便在化疗导致的恶劣环境中活下去。
顺着这个思路,研究人员发现了治疗的机会:如果在化疗中干扰癌细胞的自噬,是不是就能降低癌细胞的生存能力,避免癌症的复发?后续实验证实了这一点。研究人员测试了一种抑制自噬的小分子化合物。而失去自噬功能的癌细胞,终于被化疗药物成功杀死。
发现癌细胞免受铁死亡新机制
癌症的特征包括快速的细胞增殖和代谢活动。但这些过程也会导致细胞氧化应激的增加,以及细胞死亡风险的增加。为了规避超速生长带来的负面后果,癌细胞会刺激减少氧化应激的途径来避免细胞死亡。在一项新的研究中,来自美国莫菲特癌症中心的研究人员报告了一种新发现的生化途径,该途径可以保护癌细胞免受一种叫做铁死亡(ferroptosis)的细胞死亡。相关研究结果近期发表在Cell Metabolism期刊上。
铁死亡是一种特殊类型的细胞死亡,是由细胞内氧化不平衡引起的。铁死亡会导致细胞膜中的脂质分子发生变化,可以由半胱氨酸饥饿(cysteine starvation,指的是半胱氨酸缺乏)引起。
半胱氨酸是一种氨基酸,是蛋白的组成成分之一,也被身体用于许多重要的生理过程,包括细胞生存、对氧化还原反应的调节和能量转移。鉴于半胱氨酸在正常过程中起着关键作用,对半胱氨酸进行高度调控以防止这种氨基酸的过量或不足。
一些不同类型的癌症过度表达在半胱氨酸调节中起重要作用的分子。这表明降低半胱氨酸水平可能会对癌症生长产生负面影响。事实上,已有研究表明,抑制半胱氨酸摄取或让癌细胞遭受半 胱氨酸饥饿,可以诱导癌细胞经历细胞死亡。然而,半胱氨酸饥饿刺激的下游过程尚不清楚。在这项新的研究中,这些研究人员进行了一系列的实验室调查,以了解半胱氨酸被剥夺后哪些分子被激活,以及这会如何影响细胞。
研究人员发现,癌细胞可以激活保护自己免受半胱氨酸饥饿导致的细胞死亡的信号通路。当他们让非小细胞肺癌细胞经历半胱氨酸饥饿时,这些癌细胞开始发生铁死亡。然而,半胱氨酸饥饿也导致一种名为γ-谷氨酰肽(γ-glutamyl-peptide)的小分子的意外积累,这种小分子可以保护癌细胞免受铁死亡。他们发现γ-谷氨酰肽是通过蛋白GCLC的活性合成的。在正常情况 下,GCLC参与了利用半胱氨酸和谷氨酸合成抗氧化剂谷胱甘肽的第一步。然而,这种新发现的GCLC活性发生在半胱氨酸缺乏的情况下,并且对限制谷氨酸积累和这种氧化剂产生很重要。
研究人员进一步分析了控制GCLC介导的肽合成的信号机制,发现GCLC受到蛋白NRF2的调控。他们发现,在正常条件下,NRF2调节GCLC以产生谷胱甘肽,但在半胱氨酸饥饿的条件下,NRF2调节GGLC产生以γ-谷氨酰肽。
论文通讯作者、莫菲特癌症中心癌症生理学系助理成员Gina DeNicola博士说,“众所周知,NRF2在阻止细胞氧化中起着重要作用,并且在肺癌中经常失调。NRF2阻止铁死亡的能力对癌症有重 要意义,特别是肺癌。在肺癌中,通常通过KEAP1和NRF2发生突变来激活NRF2。”

帮助免疫系统识别肿瘤细胞
日前,四川大学生物治疗国家重点实验室巩长旸研究员团队在材料领域的国际一流学术杂志《Advanced Functional Materials》(《先进功能材料》)发表论文,其团队在全球首次通过胞内阻断方式完成肿瘤细胞CD47和PD-L1双免疫检查点的彻底阻断,通过“靶向递送”的方式,达到精准杀死肿瘤细胞而不伤及正常细胞的目的。更重要的是,极大地提高了对肿瘤细胞的杀伤力。
目前,这项研究已经完成小鼠实验,并取得良好效果,预计5年左右能够进入临床试验,10年左右有望进入临床运用。
据巩长旸介绍,其团队开展的这项研究,核心是调动人体自身免疫系统,去发挥杀死肿瘤细胞的作用。该研究是基于2018年诺贝尔生理学或医学奖获得者发现的“免疫检查点疗法”。也就是说,诺奖得主发现了可以编辑基因组的工具,巩长旸团队利用这个工具实现了编辑肿瘤细胞内的两个免疫检查点,达到了更好的抗肿瘤效果。
举个例子:免疫系统相当于是“警察”,肿瘤细胞相当于是“坏人”,当正常细胞通过时,免疫系统予以识别,对上了“暗号”就认为是“自己人”,放行;对不上“暗号”,就识别为“坏人”,随即启动机体免疫反应,正常细胞对肿瘤细胞发起“围攻”。也就是说,免疫系统在保护正常细胞不被自身攻击的同时,还有一个作用就是要抓捕肿瘤细胞,并将其杀灭。
然而,肿瘤细胞是一类非常“狡猾”的细胞,这些“坏人”在长期的“战斗”中也积累了丰富的经验,极其善于伪装,它会想办法制作不同的“假证件”,即免疫检查点,以逃避免疫系统的检查。当“警察”看到伪装的肿瘤细胞时,由于缺乏足够多的识别手段,于是将其放走,给肿瘤细胞提供了生存的机会。
为了帮助免疫系统提高识别能力,巩长旸和他的团队目前研发了一种具有模仿天然病毒结构,并可以识别肿瘤细胞的基因药物。这种药物能够精准达到肿瘤细胞,摧毁其迷惑“警察”的“假证件”,让免疫系统自主杀死肿瘤细胞,而不伤及其余正常细胞。其抗癌原理,与天然抗肿瘤药用真菌白桦茸通过调节免疫系统来达到抑制癌细胞增殖,诱发癌细胞凋亡的机制有着类似之处。

特别声明:本文来源为腾讯网、生物谷、四川在线等媒体;本文图片来自网络,如有侵权请联系删除。